Wat vindt u van genbewerking? Laat het ons weten via de enquête!
Wie zou er niet in goede gezondheid 150 jaar willen worden? Het klinkt misschien als sciencefiction, maar dankzij genetische modificatie kan het binnenkort werkelijkheid worden. Velen geloven dat dit de toekomst is, zeker nu we CRISPR technologie hebben. Omdat genetische modificatie steeds makkelijker wordt, zal het in de toekomst ook steeds vaker toegepast worden en een grotere rol spelen in ons leven. Het is daarom belangrijk dat we de techniek beter leren begrijpen. Laten we bij het begin beginnen.
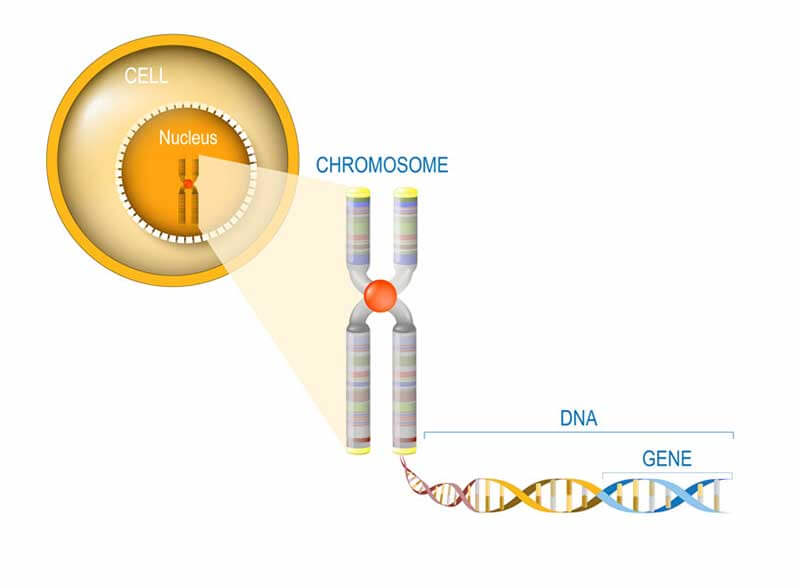
Ons DNA, onze genen en onze eiwitten
Genen zijn een onderdeel van ons DNA, de genetische code die we van onze ouders erven en zich in de kern van elke cel in ons lichaam bevindt. Het bestaat uit kleine eenheden, die samen de code vormen voor alle ‘machientjes’ die onze cellen nodig hebben om te overleven. Vijftig procent van ons DNA krijgen we van onze vader, de andere helft van onze moeder. De cellulaire machientjes worden ook wel eiwitten genoemd. Voor elk eiwit is er een stukje DNA code, wat een een gen genoemd wordt. Mensen hebben tenminste 19.000 genen, maar er is nog geen consensus over het exacte aantal.
Genen coderen dus voor eiwitten. De functies die deze eiwitten hebben verschilt. Sommige eiwitten maken energie, terwijl andere zich in het bloed bevinden om signalen te vormen voor andere delen van het lichaam. Er zijn zelfs eiwitten die andere eiwitten maken door de genetische code van het DNA te lezen. Er kunnen fouten, genaamd mutaties, ontstaan in de het DNA. Om fouten in eiwitten te voorkomen – eiwitten met afwijkingen werken namelijk niet goed – is het essentieel dat de genetische code vrij is van mutaties. Gelukkig zijn er ook eiwitten die het DNA controleren op fouten en deze repareren.
Toch kan het voorkomen dat er een mutatie tussendoor glipt, zelfs met alle controle-eiwitten. Gelukkig zorgen niet alle mutaties voor problemen, maar sommige kunnen ziektes veroorzaken. Met genetische modificatie proberen wetenschappers of doktoren een (deel van een) gen te vervangen om een ziekte-veroorzakende mutatie te repareren.
Fouten in genen veroorzaken mutaties
Genetische mutaties vormen de basis van vele ziektes. Sommige mutaties zijn erfelijk, wat betekent dat je ouders een mutatie hebben en deze doorgeven aan jou. Ziekteverwekkende mutaties kunnen echter ook een generatie overslaan. Zo kunnen je ouders een ziekte aan jou doorgeven zonder dat zij zelf ziek zijn.
Een ziekte overerven
De ziekte van Huntington is een goed voorbeeld van een erfelijke ziekte. Wanneer één van je ouders deze ziekte heeft, heb je zelf vijftig procent kans het ook te krijgen. Deze neurodegeneratieve aandoening zorgt dat je hersencellen langzaam afsterven. Het Huntington’s Disease (HD) gen is verantwoordelijk voor deze ziekte en is de code voor het zogenaamde huntingtin eiwit. Als je de mutatie hebt, zijn zowel het gen als het eiwit veel langer dan normaal. Dit zorgt ervoor dat het eiwit giftig is voor de hersencellen. Iedereen met deze mutatie krijgt deze ongeneeslijke ziekte. Er is echter een ‘lichtpuntje’. De eerste symptomen van de ziekte zijn meestal pas zichtbaar rond het 40ste levensjaar, waardoor er veel tijd is om het foutieve gen te vervangen door de kortere, gezonde variant. Hierdoor behoort de ziekte van Huntington binnenkort wellicht tot het verleden.
Kanker stoppen
Een andere genetische aandoening die grote problemen veroorzaakt door genetische fouten is kanker. Dit ontwikkelt zich doordat meerdere mutaties, in verschillende genen, zich ophopen in het DNA. Stel je voor dat je het DNA van de tumor test en alle genen met mutaties identificeert. Dan zou je de foutieve genen in alle cellen in je lichaam kunnen vervangen door de gezonde varianten. De tumor zou worden verwijderd en kans op terugval zou niet groter zijn dan een normale kans op kanker. Zelfs de groei van uitzaaiingen zou gestopt kunnen worden, aangezien de modificatie ook hun mutaties zou repareren.
Levensverlenging
Nog een veelbelovend aspect van genetische modificatie is de mogelijkheid tot levensverlenging. Veel onderzoek laat zien dat de genen die de levenslengte beïnvloeden, betrokken zijn bij het bijhouden van de hoeveelheid energie in een cel. Als er minder energie aanwezig is, verandert de activiteit van deze genen, waardoor de levensduur toeneemt. Het is bekend dat minder eten directe invloed heeft op de levenslengte, waarschijnlijk doordat de cellen dan minder energie ter beschikking hebben. Met behulp van genetische modificatie kunnen we de activiteit van genen die betrokken zijn bij veroudering zo verhogen en verlagen dat de levensduur verlengd wordt. Dit is al gedaan in wormen, gist, vliegen en muizen – met verrassende resultaten. Sommige wormen leven zes keer langer en muizen kunnen tot twee keer zo oud worden. Dit laat zien dat de levensduur verlengd kan worden door de activiteit van deze genen te beïnvloeden. Nog belangrijker is dat de genen die hier in wormen, vliegen en muizen voor zorgen ook aanwezig zijn in mensen. Dat betekent dat mensen mogelijk ook behandeld zouden kunnen worden om langer een gezond leven te leiden. Stel je voor dat je op je 25ste een korte genmodificatie zou ondergaan, waarna je in goede gezondheid 150 jaar of ouder wordt!
Genen modificeren met CRISPR-Cas9
De CRISPR-Cas9 techniek is nog niet zo lang geleden ontdekt in bacteriën, waar het dient als een verdedigingsmechanisme tegen virussen. Het systeem maakt gebruik van het Cas9 eiwit, dat DNA kan knippen. Je kunt het zien als een moleculaire schaar die de replicatie van virussen tegenhoudt. Het Cas9 bindt aan een ander klein molecuul, gids RNA, wat niet alleen veel op DNA lijkt, maar er ook aan kan binden. Zoals Ellen Jorgensen, moleculair bioloog en mede-oprichter van ‘s werelds eerste gemeenschapslaboratorium, het beschrijft in haar TED talk hieronder: “Het gids RNA is de riem voor het Cas9 eiwit, wat ervoor zorgt dat Cas9 uit het genoom blijft totdat de specifieke plek, waar geknipt moet worden, is gevonden.”
Wetenschappers kunnen het gids RNA zo ontwerpen dat het een specifiek gen naar keuze kan binden, zoals bijvoorbeeld het HD gen. Zodra het gids RNA zijn doelwit gebonden heeft, knipt Cas9 het DNA. Vervolgens zal de cel het DNA proberen te repareren door het weer aan elkaar te plakken. Als wetenschappers op dat moment een gezond HD gen aan de cel toevoegen, zal deze op de plek komen waar eerst het foutieve gen zat. Zo kunnen ze de ziekte genezen. Deze techniek kan op alle genen in het DNA toegepast worden en geeft wetenschappers controle over welke genen actief zijn en welke niet.
Aangezien Cas9 een eiwit is, bestaat er ook een stukje DNA – een gen – dat ervoor codeert. Dit betekent dat het machientje en het gids RNA aan het DNA van elke cel toegevoegd kunnen worden met behulp van technieken die al bestaan. Daar komt bij dat CRISPR – zodra het foutloos werkt – in alle levensfases gebruikt zou kunnen worden, van een bevruchte eicel tot een persoon van 70 jaar.
Planten hebben ook genen
Niet alleen mensen en dieren, maar ook planten, hebben DNA en genen. We gebruiken planten voor verschillende doeleinden, maar voornamelijk leveren ze ons fruit en groenten voor consumptie en voorzien ze ons lichaam van gezonde en essentiële voedingsstoffen. Genen in het DNA van de plant coderen voor de meeste gezonde stoffen die we van ze krijgen. Met behulp van genetische modificatie kunnen wetenschappers voedingsstoffen toevoegen aan onze gewassen. Dit wordt biofortificatie genoemd. Een perfect voorbeeld van biofortificatie is de zogenaamde ‘gouden rijst‘. Het krijgt zijn naam door zijn gouden kleur, die het resultaat is van bètacaroteen, een stof die wetenschappers in de rijst geïntegreerd hebben om het gezonder te maken. Ons lichaam zet bètacaroteen om in vitamine A.
De ontwikkeling van deze rijst is belangrijk, omdat ongeveer een derde van de kinderen onder de vijf jaar wereldwijd aan vitamine A-tekort (VAD) lijdt. Het is de belangrijkste oorzaak van blindheid bij kinderen. Het toedienen van vitamine A-supplementen is duur en inefficiënt. Wetenschappers hebben echter aangetoond dat slechts 72 gram droge gouden rijst per dag voldoende is om VAD te voorkomen. Aangezien rijst de voornaamste basisvoeding is in de meeste landen waar VAD voorkomt, is het een goedkope en eenvoudige oplossing om voedingsstoffen aan te vullen op deze manier. Met genbewerking kunnen we voedingsstoffen toevoegen aan allerlei soorten groenten en fruit. Zo kunnen we ervoor zorgen dat iedereen – niet alleen mensen in derdewereldlanden – een gezonder leven leidt.
Ethiek van genetische modificatie
Een van de grootste problemen van genetische modificatie is de controverse die er omheen hangt. Sommige mensen vinden dat met genen niet gespeeld mag worden, terwijl anderen hier geen problemen of limieten zien. We zouden, bijvoorbeeld, kleurenblindheid kunnen genezen waardoor een patiënt het hele kleurenspectrum weer kan zien. Maar we zouden in dat geval ook kleuren kunnen toevoegen aan het zicht van gezonde individuen, en hoewel daar uiteraard geen medische noodzaak voor is, zijn er vast mensen die dit willen proberen.
Genetische modificatie maakt veel andere nuttige dingen mogelijk. Zo zouden we het kunnen gebruiken om antivirale of antibacteriële CRISPR-Cas9 systemen toe te voegen aan het genoom van jonge kinderen. Wanneer ze een infectie krijgen, zorgt hun CRISPR-Cas9 vaccinatie er vervolgens voor dat de virussen of bacteriën niet kunnen overleven, waardoor een kunstmatige vorm van immunisatie ontstaat. Een soortgelijke methode wordt al getest voor de behandeling en preventie van HIV. Als deze methode succesvol blijkt, is dat een eerste stap naar genetische vaccinaties.
Maar we kunnen ook het DNA van onze ongeboren kinderen controleren op genetische afwijkingen en hun genen aanpassen als dat nodig mocht zijn. Als ons kind de Huntington mutatie heeft, kunnen we dat repareren. En als we toch bezig zijn, zouden we ook de oog- en haarkleur kunnen veranderen. We kunnen ons kind dan meteen iets sterker maken door de spierontwikkeling te stimuleren. Hoe ver moeten of mogen we gaan? Het is belangrijk onderscheid te maken tussen de ethische en biologische verschillen tussen het genetisch modificeren van ei- en spermacellen ten opzichte van andere celtypes. Het belangrijkste verschil is dat bij het modificeren van voortplantingscellen het DNA wordt aanpast voor alle volgende generaties, terwijl het aanpassen van andere cellen alleen invloed heeft op één persoon. Elk heeft zijn eigen ethische punten om te overdenken. Veel mensen uit de wetenschappelijke gemeenschap, maar ook daarbuiten, hebben gewaarschuwd voor de consequenties van CRISPR, wanneer het overhaast voor menselijke genetische modificatie gebruikt zal worden.
De intenties zijn over het algemeen goed, maar genetische manipulatie zou ook de ongelijkheid tussen bevolkingsgroepen kunnen vergroten, aangezien de technologie in het begin waarschijnlijk alleen toegankelijk zal zijn voor de rijken. “Zodra je een bevolking creëert waarin kinderen van de rijken biologische voordelen krijgen ten opzichte van andere kinderen, zullen de basisbegrippen van menselijke gelijkheid verdwijnen,” waarschuwt David King, ex-moleculaire bioloog en oprichter van Human Genetics Alert, in The Guardian.
Met andere woorden, genetische modificatie heeft de toekomst, maar alleen als het goed beheerd en gecontroleerd wordt. We hebben wetgeving en commissies nodig die het onderzoek en de ontwikkeling in goede banen leiden. Alleen dan kunnen we echt voorbereid zijn op de toekomst van genetische modificatie.
Share via:


