- Nieuw soort chemotherapie werkt als een Trojaans paard
- Kunnen we kankercellen in de toekomst in onschuldige vetcellen veranderen?
- Immunotherapie als kankerbehandeling wordt steeds veelbelovender
- Is MuTaTo te mooi om waar te zijn?
- De Tumor Monorail
- DNA-nanobots vernietigen kankercellen door hun bloedtoevoer af te sluiten
- Gaan we een toekomst zonder kanker tegemoet?
Ons lichaam bestaat uit biljoenen cellen die weefsels en organen vormen en al deze cellen groeien, delen en sterven op basis van een specifiek patroon. Maar als gevolg van (al dan niet genetisch bepaalde) mutaties kunnen cellen extreem snel gaan groeien, waardoor tumoren ontstaan. Kwaadaardige tumoren – of kankergezwellen – kunnen in één deel van het lichaam ontstaan, maar ze kunnen zich ook razendsnel naar andere delen verspreiden. Dit proces heet metastase.
Volgens de World Health Organisation kostte kanker in 2018 aan 9,6 miljoen mensen wereldwijd het leven.
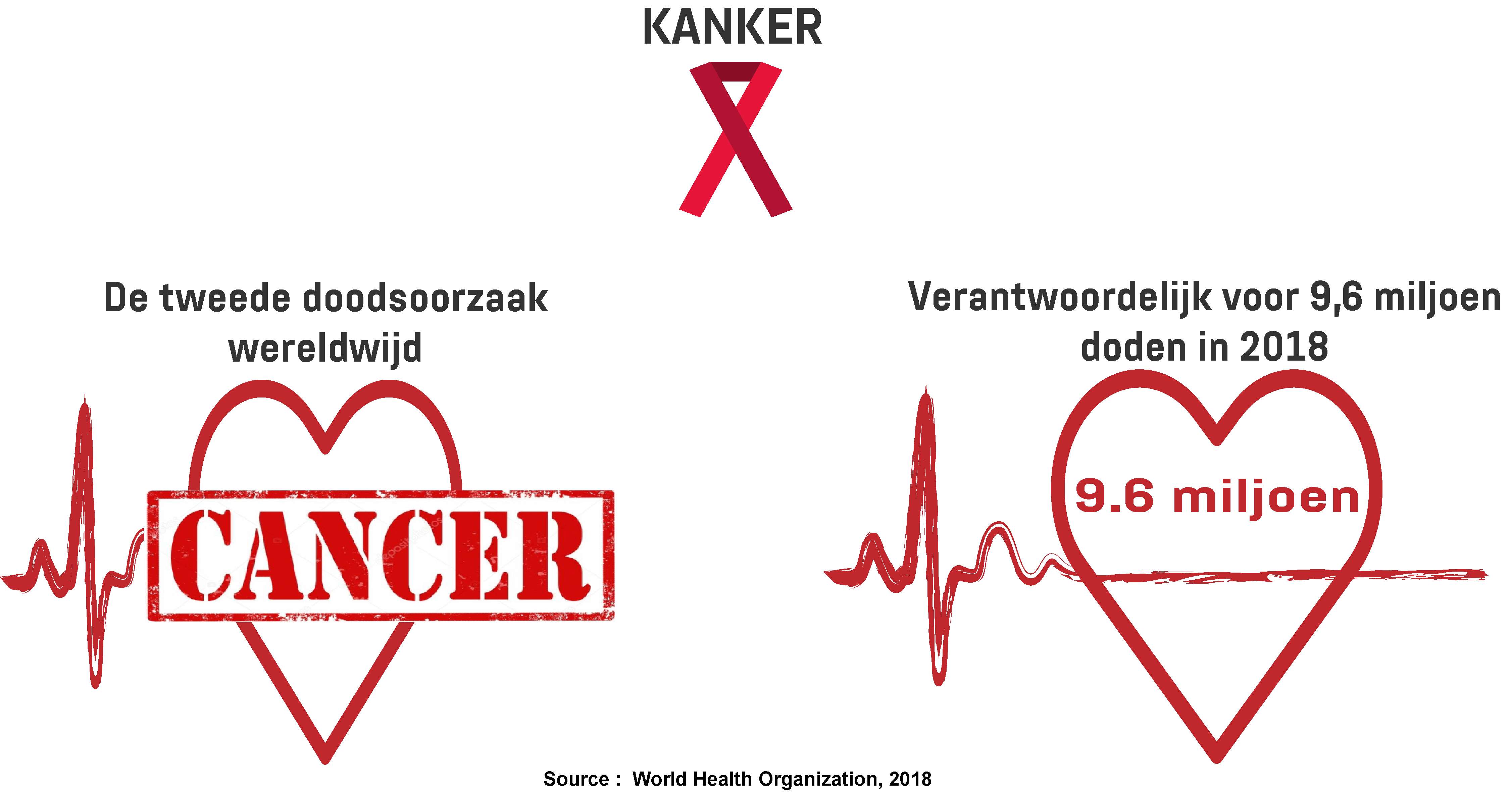
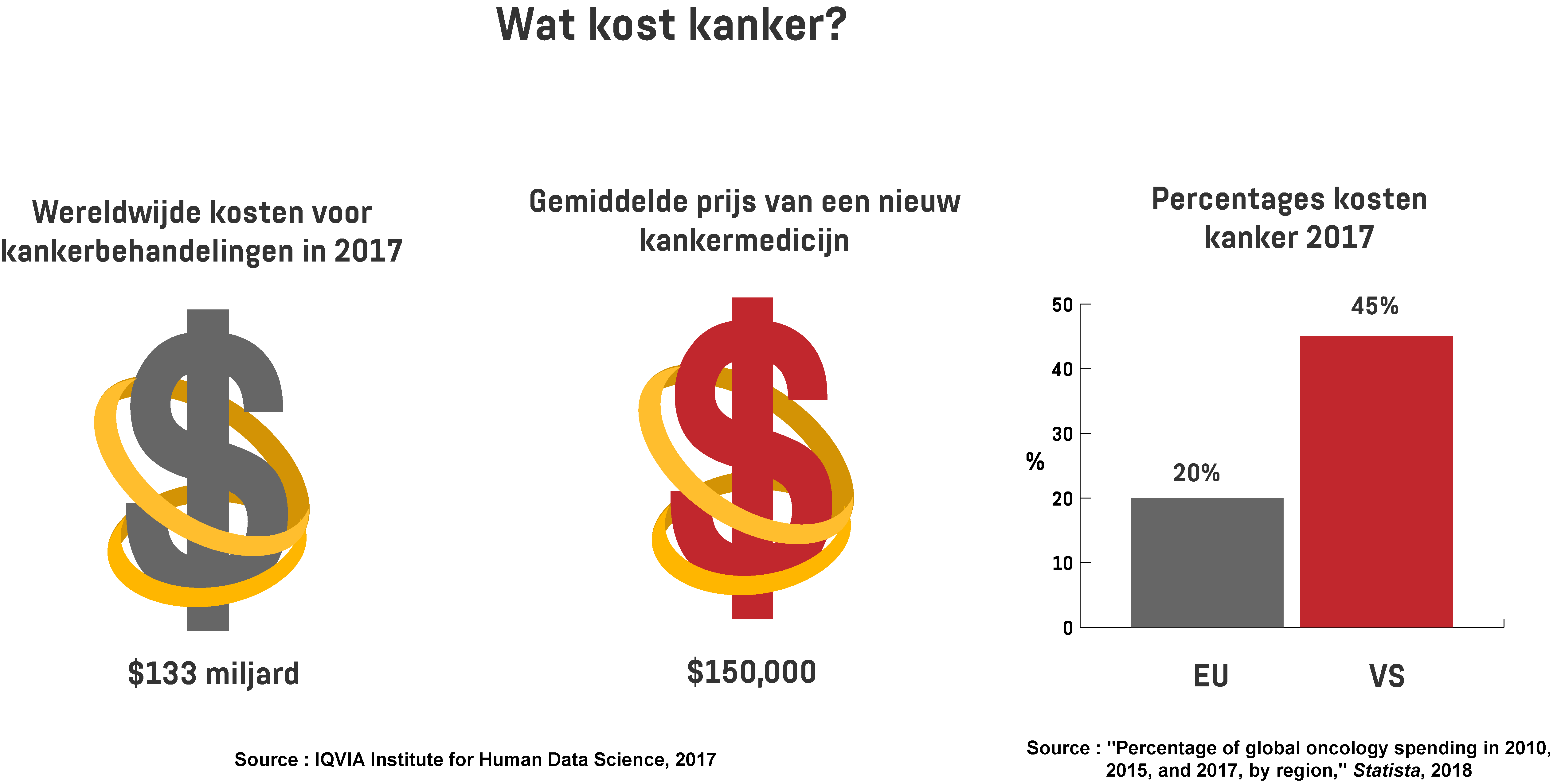
Daarmee is de ziekte doodsoorzaak nummer twee. De meest voorkomende soorten kanker zijn long-, borst- en darmkanker. Als het in een vroeg stadium wordt ontdekt – en afhankelijk van het type kanker – kan het sterftecijfer in sommige gevallen worden teruggedrongen. Maar de behandelingen zijn complex en kostbaar. Volgens schattingen werd er in 2017 wereldwijd maar liefst $133 miljard aan kankergeneesmiddelen uitgegeven en de gemiddelde prijs van nieuwe kankerbehandelingen bedroeg $150.000. Europa was verantwoordelijk voor 20 procent van dit bedrag en 45 procent was afkomstig uit de VS. In een onderzoek van de non-profit Kaiser Family Foundation is 72 procent van de Amerikaanse bevolking van mening dat de kosten van deze geneesmiddelen onredelijk zijn. Bovendien zijn bestaande kankerbehandelingen onvoorspelbaar omdat ze geen garantie bieden op een (blijvend) positief resultaat.
Om oplossingen te vinden voor deze uitdagingen en de effectiviteit van kankerbestrijding te verbeteren, blijven wetenschappers over de hele wereld zich onvermoeibaar inzetten voor kankeronderzoek. Enkele belangrijke recente doorbraken zouden de toekomst van de gezondheidszorg volledig kunnen veranderen.
Nieuw soort chemotherapie werkt als een Trojaans paard
Een van die doorbraken werd bereikt door een onderzoeksteam van het Institute of Cancer Research (ICR) en The Royal Marsden NHS Foundation Trust. Ze creëerden het medicijn tisotumab vedotin (TV), een combinatie van een chemotherapeutisch middel en een antistof dat zich gedraagt als een ‘Trojaans paard’. De antistof verbindt zich namelijk met de kankercel, dringt er naar binnen en vervolgens vernietigt het de kankercel van binnenuit. De onderzoekers hebben het medicijn getest bij 147 patiënten met verschillende soorten kanker. De meeste deelnemers hadden kanker in een vergevorderd stadium en reageerden niet (meer) op andere behandelingen.
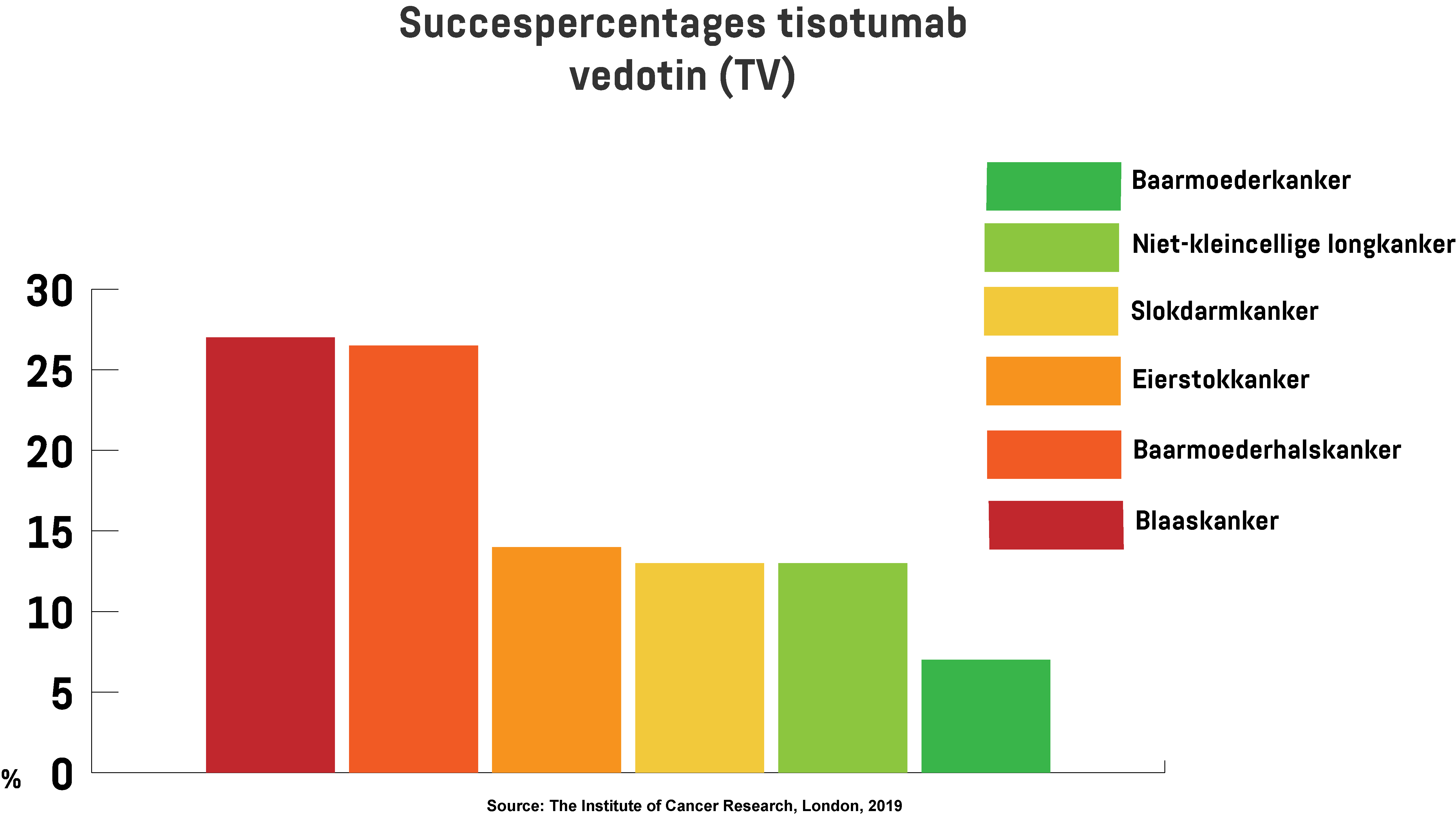
De resultaten, gepubliceerd in het tijdschrift The Lancet Oncology, laten zien dat verschillende deelnemers goed reageerden op het medicijn en dat hun kankercellen kleiner werden of helemaal niet meer groeiden. Zo is bijvoorbeeld gebleken dat TV een positief effect had op 27 procent van de patiënten met blaaskanker, 26,5 procent met baarmoederhalskanker, 14 procent met eierstokkanker en 7 procent van de deelnemers met baarmoederkanker.
Het positieve effect duurde gemiddeld 5,7 maanden en bij sommige patiënten zelfs 9,5 maanden. De behandeling veroorzaakte echter enkele bijwerkingen, zoals misselijkheid, vermoeidheid en neusbloedingen. Professor Johann de Bono merkt op dat dergelijke bijwerkingen echter allemaal te behandelen zijn. Op basis van de bevindingen concludeerde het team dat hun nieuwe medicijn het potentieel heeft om patiënten met verschillende soorten kanker te behandelen, inclusief patiënten met lage overlevingskansen. Het team is onlangs begonnen aan een nieuwe testronde met long- en alvleesklierkanker patiënten.
Kunnen we kankercellen in de toekomst in onschuldige vetcellen veranderen?
Ook wetenschappers van de Universiteit van Bazel in Zwitserland hebben aanzienlijke vooruitgang geboekt met hun onderzoek. Ze ontwikkelden een manier om borstkankercellen om te zetten in onschadelijk vet. Borstkanker is het meest voorkomende type kanker bij vrouwen. Elk jaar worden 2,1 miljoen vrouwen met borstkanker gediagnosticeerd en in 2018 overleden er 627.000 vrouwen aan de gevolgen van deze ziekte. Veel borstkankerpatiënten overlijden uiteindelijk doordat de kankercellen tijdens metastase andere delen van het lichaam aantasten. De metastase is een overgangsfase die ook wel epithelio-mesenchymale overgang (EMT) genoemd wordt – een periode waarin de kankercellen vanuit de oorspronkelijke tumor(en) naar andere organen migreren. De onderzoekers ontdekten dat het mogelijk was om de kankercellen tijdens deze overgangsfase in vet te veranderen. Ze injecteerden vrouwelijke muizen met (menselijke) borstkankercellen. Vervolgens kregen de muizen het diabetesmedicijn rosiglitazone, en de kankerremmer tramenitib toegediend, beide goedgekeurd door de FDA, waarna de kankercellen in vetcellen veranderden. Bovendien onderdrukten de medicijnen de groei van de primaire tumoren en voorkwamen ze uitzaaiingen.
In de toekomst willen de wetenschappers hun doorbraak combineren met traditionele chemotherapie om te voorkomen dat tumoren groeien en uitzaaiingen veroorzaken. Ze willen ook onderzoeken welk effect deze behandeling zou hebben op andere soorten kanker.
Immunotherapie als kankerbehandeling wordt steeds veelbelovender
Een andere recente ontwikkeling in de kankerbestrijding is gebaseerd op het gebruik van het immuunsysteem. De behandeling, die naar verwachting in de loop van dit jaar op menselijke patiënten zal worden getest, is ontwikkeld door onderzoekers van het Francis Crick Institute in Londen. Voor deze specifieke behandeling – immunotherapie, een behandeling waarbij het eigen immuunsysteem wordt aangezet de kanker te bevechten – wordt gebruik gemaakt van de immuuncellen van gezonde donoren. Deze worden vervolgens bij kankerpatiënten geïmplanteerd om het lichaam te helpen de kanker zelf te bestrijden. Dit zou zelfs het tienjarig overlevingspercentage kunnen verhogen van 50 tot 75 procent.
Bij het inschakelen van het eigen immuunsysteem zijn behandelingen als chemotherapie niet meer nodig en zijn er dus ook geen bijwerkingen. In plaats van het lichaam van de patiënt te bombarderen met chemicaliën, kunnen artsen het immuunsysteem van de patiënt nu ondersteunen met ziektebestrijdende immuuncellen. Een van de onderzoekers die betrokken is bij het project, Charlie Swanton, is ervan overtuigd dat ons immuunsysteem de komende twee decennia een efficiënt wapen zou kunnen zijn bij de behandeling van verschillende soorten kanker. De onderzoekers willen ‘banken’ creëren waar men gezonde immuuncellen kan opslaan, zodat artsen deze kunnen bestellen en binnen enkele uren kunnen implanteren in het lichaam van hun patiënt. Deze benadering is veel effectiever dan bestaande immunotherapiemedicijnen, waarbij ook gezonde cellen beschadigd of vernietigd worden. Bovendien is het zo dat kanker zich snel razendsnel ontwikkelt en het is voor farmaceutische bedrijven bijna onmogelijk om de ontwikkelingen bij te benen. Deze ultieme ‘doe-het-zelf’-aanpak zou dan ook een zeer veelbelovend alternatief kunnen zijn.
Is MuTaTo te mooi om waar te zijn?
Veel van deze ontdekkingen en ontwikkelingen bevinden zich nog in een vroeg stadium, maar het Israëlische farmaceutische bedrijf Accelerated Evolution Biotechnologies (AEBi) beweert dat het binnen een jaar een medicijn heeft dat met kanker kan afrekenen. Het geneesmiddel heet MuTaTo, wat staat voor multi-target toxin. MuTaTo maakt gebruik van peptiden (ketens van aminozuren), die goedkoop en gemakkelijk te produceren zijn. Deze bevatten een sterk gif waarmee kankercellen vernietigd worden. De meeste kankermedicijnen vallen één voor één een specifiek doelwit in de cel aan. Maar MuTaTo werkt anders. “In plaats van receptoren één voor één aan te vallen, vallen we er drie tegelijk aan. Zelfs kanker is niet in staat om drie receptoren tegelijkertijd te muteren”, zegt Dr. Ilan Morad, de CEO van AEBi. Om zichzelf te verdedigen, gebruiken kankercellen detoxificatiemechanismen die het vergif als het ware wegpompen. Maar dat kost tijd en als het gif maar sterk genoeg is kan het de kankercel vernietigen voordat het aan de ontgifting kan beginnen, menen de onderzoekers.
Het is de bedoeling om gepersonaliseerde behandelingen te ontwikkelen, omdat niet elke patiënt op dezelfde manier op kankermedicijnen reageert. Bovendien is elke tumor weer anders. Bij elke patiënt wordt dan ook een stukje weefsel afgenomen voor analyse in het lab. Vervolgens weet de arts welke ‘molecuulcocktail’ er nodig is om de ziekte te lijf te gaan. Omdat de cocktails zo effectief zijn, zou de behandeling al na een aantal weken gestaakt kunnen worden. Tot nu toe hebben de onderzoekers van AEBi alleen nog experimenten met muizen uitgevoerd, waarbij het medicijn de groei van kankercellen kon voorkomen zonder gezonde cellen aan te tasten. Ze starten binnenkort echter ook met klinische proeven en zijn ervan overtuigd dat deze succesvol zullen zijn en behandelingen voor specifieke gevallen van kanker mogelijk maken.
De Tumor Monorail
Een andere belangrijke recente doorbraak is de Tumor Monorail, ontwikkeld door wetenschappers van Georgia Tech en Emory University en door de FDA een ‘doorbraakapparaat’ genoemd. Het concept, waarover in 2014 in Nature Materials werd geschreven, is ontworpen om agressieve hersentumoren als glioblastoma beter onder controle te krijgen. Glioblastoma is een ernstige vorm van kanker in de hersenen (of het ruggenmerg) die voornamelijk voorkomt bij ouderen. Deze tumoren zijn erg moeilijk te behandelen, waardoor de diagnose glioblastoma vaak gelijk staat aan een doodvonnis. Maar de Tumor Monorail kan glioblastoma-patiënten helpen de strijd tegen deze kankersoort te winnen.
Het apparaat lijkt op een lange, dunne katheterbuis met een klein reservoir aan het uiteinde dat zich onder de hoofdhuid bevindt. De monorail wordt ook wel de ‘Pied Piper’ (rattenvanger) genoemd. Het lokt kankerachtige tumoren om te voorkomen dat deze zich dieper in de hersenen verspreiden. Het doet dit door de witte hersenstof na te bootsen. Neurochirurgen hebben toegang tot het reservoir zodat ze de verzamelde cellen periodiek kunnen verwijderen. Tijdens vroege experimenten op ratten slaagde de Tumor Monorail erin om de kankercellen naar het met gif gevulde reservoir te lokken, waardoor de verspreiding van kankercellen vertraagd werd en de tumor met meer dan 90 procent slonk. Dit was “de eerste proef waarin we lieten zien hoe je de tumor als het ware naar het medicijn lokt, in plaats van dat je het medicijn de hersenen in stuurt waar het ook gezonde cellen vernietigt”, vertelt een van de onderzoekers, Ravi Bellamkonda. Het team is optimistisch dat ze tegen het einde van dit jaar het groene licht krijgen om hun innovatie op menselijke patiënten te testen.
DNA-nanobots vernietigen kankercellen door hun bloedtoevoer af te sluiten
Een internationaal team van onderzoekers uit onder andere China, Australië en de VS heeft laten zien hoe nanobots kunnen worden gebruikt om verschillende vormen van kanker te bestrijden. Elke nanobot is gemaakt van een laagje DNA dat buisvormig opgevouwen wordt en het bloedstollende medicijn trombine bevat. Dit medicijn wordt vaak gebruikt om bloedingen te stoppen door de bloedtoevoer naar de bloedvaten af te sluiten. Wanneer de bloedtoevoer wordt onderbroken, kunnen kankercellen niet langer groeien waardoor het kankerweefsel uiteindelijk afsterft. De nanobots zijn volkomen veilig en vormen geen enkele bedreiging voor gezond weefsel.
Deze innovatieve methode is getest op muizen en de resultaten van de onderzoeken zijn gepubliceerd in het tijdschrift Nature Biotechnology. Volgens de onderzoekers waren de bloedvaten die de primaire tumor van bloed voorzagen binnen 24 uur na de behandeling afgesneden. In de 72 daarna begon de tumor af te sterven. Deze techniek heeft de levensduur van de muizen tot 45 dagen verlengd terwijl de levensduur van de onbehandelde muizen slechts 20,5 dagen was. “We hebben het eerste volledig autonome DNA-robotsysteem ontwikkeld voor een zeer nauwkeurig medicijnontwerp en gerichte kankertherapie”, zegt professor Hao Yan, directeur van het Center for Molecular Design and Biomimetics van Arizona State University Biodesign Institute. “Deze technologie kan voor veel soorten kanker worden gebruikt, omdat alle bloedvaten die vaste tumoren van bloed voorzien in wezen hetzelfde zijn”. Hoewel tot nu toe alleen nog met muizen is geëxperimenteerd, denkt Yan dat echte, praktische medische toepassingen van de technologie niet lang op zich zullen laten wachten.
Gaan we een toekomst zonder kanker tegemoet?
Kanker is zonder twijfel een van ’s werelds grootste gezondheidsproblemen. Het aantal mensen dat met kanker gediagnosticeerd wordt groeit in alarmerend tempo en de ziekte kost elk jaar aan miljoenen mensen het leven. Wetenschappers werken onafgebroken aan oplossingen en er zijn de laatste jaren dan ook een aantal opmerkelijke doorbraken geweest. Recente ontwikkelingen kunnen de diagnostiek en behandeling van kanker effectiever en goedkoper maken, waardoor patiënten betere overlevingskansen krijgen. Hoewel we nog steeds geen ‘wondermiddel’ hebben waarmee we voor goed korte metten kunnen maken met deze vreselijke ziekte, zijn deze nieuwe ontwikkelingen een zeer veelbelovende stap in de goede richting.
Het zou geweldig zijn als we de ziekte na al die jaren en miljardeninvesteringen eindelijk onder controle zouden kunnen krijgen. In de toekomst kunnen artsen wellicht nanobots ontwikkelen die kankercellen opsporen en vernietigen. Of misschien kunnen ze de genetische mutaties die kanker veroorzaken straks door middel van genbewerking elimineren. Met elke nieuwe doorbraak op dit gebied komen we in ieder geval dichter bij een toekomst zonder kanker.
Share via:


